最新消息
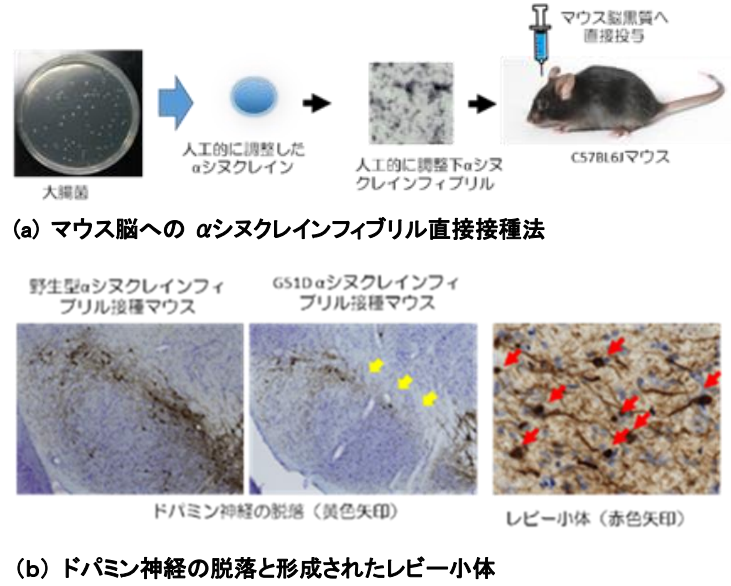
大阪大学于10月24日,通过直接在小鼠脑内接种人工合成α突触蛋白,诱导帕金森病病理学特征路易体形成,并再现多巴胺神经随病情发展脱落的过程,成功制备出更加接近人类帕金森病态的病态模型。此项目由该大学研究生院医学系研究科的马场孝辅特任讲师等人组成的研究小组负责,目前研究成果已经被刊登在美国科学杂志《Movement Disorders》网络版上。
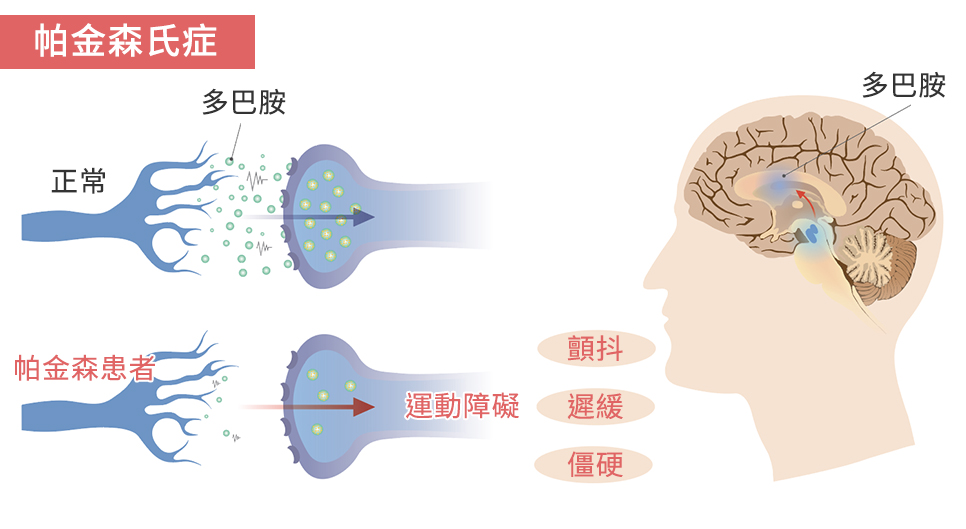
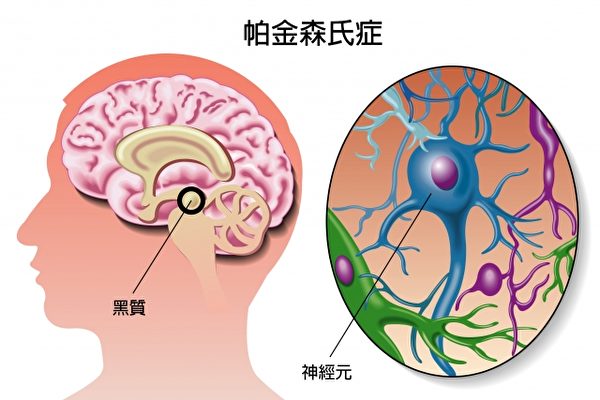
最新模型不仅可以再现路易体成形过程,也能模拟出黑质多巴胺神经的脱落。 帕金森病的病理学特征就是黑质多巴胺神经变性以及路易体生成。路易体的主要构成成分是α核苷。目前关于帕金森病最流行的病态假说是“Prion假说”,该假说认为α核苷在神经细胞内错误折叠并聚合形成凝聚体,释放出细胞毒性,进而通过细胞间传播恶化病情。近年来虽然用基于α核苷的Prion假说制备了很多动物模型,但现在很大部分人通过在小鼠脑中直接接种in vitro调整后的α-突触核蛋白聚集体进行研究。然而目前为止,使用普通(野生型)α-突触核蛋白聚集体的研究,无法完全再现α-突触核蛋白聚积后形成路易体的过程,以及发展较缓慢的黑质多巴胺神经脱落过程。 α核苷酸凝聚体的立体结构会对病情造成很大影响 研究小组此次不仅着眼于野生型α核苷,还研究了重症遗传性帕金森患者身上发现的G51D遗传基因的变异。通过对G51D变异α核苷聚合后的聚集体进行人工调整,蛋白质构造分析,以及与未变异(野生型)α核苷作对比,结果发现变异α核苷聚集体的β折叠构造含有率约为2倍。β折叠构造是异常Prion蛋白质等病态蛋白质的结构特征之一。将此G51D变异α核苷聚集体接种到小鼠的单侧黑质上,经过一段时间得出结论,和野生型α核苷聚集体相比,变异型会形成范围更广的路易体。并且接种后第十二周黑质多巴胺神经开始脱落,24周后确认观测到约70%的多巴胺神经脱落。 此研究成果显示了α核苷酸凝聚体的立体构造对帕金森病有很大的影响。这次制备的小鼠可以再现路易体缓慢发展的病理,以及黑质多巴胺神经的脱落。并且有希望查明α核苷聚集体引起的其他神经疾病(比如路易体痴呆症以及多系统萎缩症)的病理。另外还能开发出抑制帕金森病病情恶化的新型病态修饰疗法,此次研究成果将作为辅助阐明发病机理的工具,可以推动帕金森病理研究的进一步发展。研究小组认为:“由于它不需要遗传修饰,因此原则上可以适用于灵长类动物模型。” 帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病,老年人多见,平均发病年龄为60岁左右,40岁以下起病的青年帕金森病较少见。我国65岁以上人群PD的患病率大约是1.7%。大部分帕金森病患者为散发病例,仅有不到10%的患者有家族史。帕金森病最主要的病理改变是中脑黑质多巴胺(dopamine, DA)能神经元的变性死亡,由此而引起纹状体DA含量显著性减少而致病。导致这一病理改变的确切病因目前仍不清楚,遗传因素、环境因素、年龄老化、氧化应激等均可能参与PD多巴胺能神经元的变性死亡过程。大阪大学这次的研究可以说意义非常重大,不仅制备出更高精度的模型,还推动了帕金森病病理解明过程。